
允 英 速 报
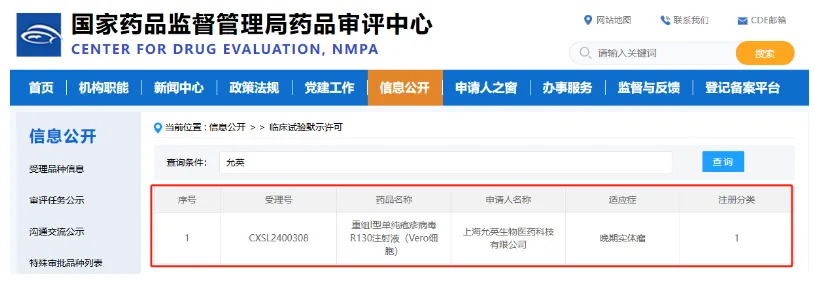
2024年7月26日,允英自主研发的第三代重组溶瘤病毒“重组I型单纯疱疹病毒R130注射液(Vero细胞)”获得国家药品监督管理局核准签发《药物临床试验批准通知书》,同意开展晚期实体瘤的临床试验,适应症为晚期实体瘤。
关于溶瘤病毒R130
溶瘤病毒是允英生物医药CancerGO新药研发平台重点项目之一。允英自主研发的第三代重组溶瘤病毒——R130可发挥“溶瘤病毒杀伤”+“免疫系统激活”的双重作用,通过R130携带的“三通路”激活免疫系统,逆转耗竭性T细胞,使其重新焕发活力!
与国内数家知名三甲医院合作开展的IIT(由研究者发起的临床研究项目)阶段,R130展现出明确的临床疗效与良好的患者耐受性、药物安全性。已有多例多线治疗失败的实体瘤患者,接受允英溶瘤病毒R130治疗后肿瘤明显缩小,其中1例高度恶性、穷尽多种治疗方式的卵巢癌患者严重腹水完全消退;1例晚期脑转移肺癌患者血性胸水完全控制、脑部转移灶消失。
此次溶瘤病毒R130获得国家药监局批准开展I期临床试验,标志着允英在为肿瘤患者带来新的安全有效的抗肿瘤治疗手段的努力中又迈出了重要的一步。
下一步,允英将正式启动R130的I期临床试验,面向社会招募实体瘤患者。

允英医疗以长三角区域为中心,辐射全中国,公司致力于打造癌症精准诊疗的新型生态圈,综合运用基因突变检测、基因甲基化检测、基因编辑重组等生物科技的前沿技术,全方位提供从癌症早期精准筛查、癌症靶向用药检测、癌症治疗药物研发一体化的肿瘤精准医学解决方案。目前在上海、浙江及青海共设有三家实验室。
允英医疗成立至今,顺利通过由国家卫健委临检中心、国家病理质控中心、美国病理学会等机构组织的室间质评。检验能力获得了美国病理学会(College of American Pathologists,CAP)认证,肿瘤核心基因检测试剂盒通过欧盟CE认证,获得国家药品监督管理局(NMPA)注册批准,且生产管理质量体系获国际ISO13485认证。目前允英已累计为近三十万例肿瘤患者提供精准检测服务,为国内肿瘤精准医疗领域开拓者。同时允英秉承“严谨、高效”的理念,坚守分子诊断技术创新与应用探索,为肿瘤精准医疗与伴随诊断领域的茁壮发展贡献力量。




